作者:庞德·陈 知产财经
2025年3月19日,国家药监局发布《药品试验数据保护实施办法(试行)(征求意见稿)》及《药品试验数据保护工作程序(征求意见稿)》,向社会公开征求意见。这标志着我国药品试验数据保护制度进入落地倒计时。
一、制度来源与定义
药品试验数据保护制度(RDP),是指对原研药企提交的未公开临床试验数据给予一定期限的市场独占权,防止其他企业直接引用该数据申报仿制药。
对原研药的试验数据进行保护,源于与之对应的另一项有利于仿制药的制度,即“简化仿制药申请流程”。仿制药是对已审批上市的药品的仿制。我国规定,仿制药应与参比制剂具有相同的活性成份、剂型、规格、适应症、给药途径、用法用量和质量。出于避免资源浪费、以及加快仿制药上市的考虑,药品监管部门减轻了仿制药企的证明责任,用一致性评价代替完整的审批流程,即仿制药只需证明其与参比制剂具有药学等效和生物等效即可。然而,据统计,原研药的开发成本至少有60%发生在临床研究阶段,而临床研究成果主要以试验数据的形式体现。如此一来,原研药相比仿制药,需额外付出高额的试验成本,而仿制药上市申请过程中对原研药企试验数据的利用便构成免费的“搭便车”行为。
为了平衡原研药企和仿制药企的利益诉求,美国在1984年通过Hatch-Waxman法案创设了药品试验数据保护制度,规定如果仿制药提交上市申请时所依据的安全性及有效性试验并非其自行完成,也未获得授权,美国药品监管部门在最先获得新药上市许可的原研药获得上市许可之日起5年内,不得批准仿制药的上市申请。药品试验数据保护制度,为自行取得试验数据的原研药企提供了专利权之外的另一种市场独占保护。该制度的核心目的是通过保护创新药对于药品试验数据的投入,以激励新药开发,促进医药产业高质量发展。
此后,美国进一步通过国际条约将该制度推广至其他国家。1993年《与贸易有关的知识产权协定》(TRIPS)第39.3条首次将药品试验数据保护上升为国际义务,要求成员国保护未披露药品试验数据,防止“不正当商业使用”和“披露”,但未明确具体保护模式(如是否采用数据独占期)。随着该制度在全球的推广落地,其适用范围也从“新化学实体”逐渐扩大至生物药、罕见病药、儿童用药等领域。
由制度的发展历史脉络观之,药品试验数据保护制度作为与简化仿制药申请流程的双生制度,旨在平衡原研药、仿制药、社会公众三方利益。但不可否认的是,在我国早已落实简化仿制药申请流程,而药品试验数据保护制度长期“缺位”的情况下,此次征求意见稿的出台,显然是对创新药企的重大利好。相应地,仿制药的上市规则也将发生重大变革,从而深刻影响医药行业创新与仿制药竞争格局。
二、我国推进历程
1.早期探索(2002-2007)
2002年《药品管理法实施条例》:首次引入6年数据保护期,但仅限含“新型化学成分”的药品,未明确保护范围和实施细节。
2007年《药品注册管理办法》:重申数据保护原则,但仍缺乏可操作性。
2.政策突破(2017-2018年)
2017年两办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》:提出对创新药、罕见病、儿童专用药等药品,分类实行数据保护期制度。
2018年《药品试验数据保护实施办法(暂行)(征求意见稿)》:明确将创新药、生物药、罕见病药等纳入保护范围,并提出具体的分类保护框架,但因争议较大未能落地。
3.法律修订与政策深化(2019-2025)
2019年:新修订《药品管理法》实施,为数据保护提供法律基础。
2022年:国家药监局发布《药品管理法实施条例(修订草案征求意见稿)》,重申6年数据保护期,但未明确“部分药品”的具体范围和“数据”定义,引发学界对操作性的讨论。
2025年1月:国务院办公厅《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》提出“分类别给予数据保护期”,释放制度细化信号。
2025年3月19日:国家药监局发布《药品试验数据保护实施办法(试行,征求意见稿)》及配套工作程序,标志着制度落地进入倒计时。
三、新规亮点:分类保护、程序细化
此次征求意见稿,在分类保护范围、期限设定和实施机制上均实现了突破:
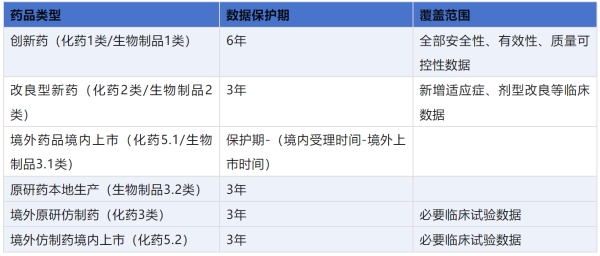
在实施机制方面,新规明确:1.申请程序:申请人需在提交上市许可时同步申请数据保护,境外药品需提供首次上市证明。2.技术审查与公示:药审中心在审评时确认保护范围和期限,并在官网公示。3.允许仿制药企在保护期届满前1年提交申请,药审中心中止审评至保护期结束。4.因药品批准证明文件被撤销、吊销、注销、持有人主动放弃数据保护等终止保护情形。
四、展望
此次征求意见稿的发布,意味着我国的药品试验数据保护制度迈入新的发展历程。相关制度若顺利实施,将显著提升医药创新生态。新的问题也继而引发关注,例如,如何进一步明确数据保护与专利链接之间的制度衔接。对此,我们将长期保持关注。
(本文仅代表作者观点,不代表知产财经立场,平台并不承诺对内容负责,如有相关疑问,请联系文章作者。)














 京公网安备 11010502049464号
京公网安备 11010502049464号