作者:周荧屏 知产财经
自2015年药品医疗器械审评审批制度改革以来,中国医药产业迅速发展,助推我国实现从“仿制药大国”向“创新药强国”的转型跨越。2021年生效的第四次修改的《专利法》引入药品专利期限补偿制度(Patent Term Extension,PTE),以补偿新药上市审评审批占用的时间,这一接轨国际通行规则的举措更进一步激发了医药产业的创新热情。国家药品监督管理局(NMPA)的数据显示,今年1-8月,我国共批准创新药56个,已超过去年全年的48个,呈现快速增长态势[1]。
不过,无论是《专利法》还是其他相关法律法规,均未直接界定可享受专利期限补偿的“新药”的范围。而从申请实践来看,相比于世界其他主要国家和地区,我国的PTE制度当前实际保护的“新药”,绝大多数情况下仅指全球范围内首次上市的“化学药、生物制品和中药新药”(即所谓“全球新”药品),而并不延及已在境外上市但尚未在境内上市的药品(即所谓“中国新”药品)。
但是,医药研发的全球化特性、临床试验的复杂性以及中国市场的特殊性,使得大量创新药物进入中国时难以满足“全球新”标准,进而无法享受政策倾斜,难以获得足够的专利权保护期限。与此同时,这些“中国新”药品进入中国时,还需承担与“全球新”药品相当甚至更重的临床试验负担。在此背景下,实质性破除对“中国新”药物的区别政策,构建更加公平的药品知识产权保护体系,已经成为我国医药产业高质量发展的必然要求。
多重现实约束,“全球新”为何难成普遍标准?
众所周知,医药研发是一项涉及科学研究、临床试验、监管审批等多环节的系统工程,其时间、金钱、人力等资源投入均极为高昂。通常而言,一项药品从药物发现到药物开发再到上市,需经历复杂的临床前研究、临床申报(IND)、临床研究、新药上市审批(NDA)等流程,整个过程通常耗时5-8年,部分复杂生物制品甚至需耗费超过10年。而与此同时,药品的核心专利则需在研发早期阶段便进行申请,至新药正式获批上市之时,往往已消耗10-15年的专利保护期,距离全球多数国家和地区规定的20年专利法定保护期限仅剩下5-10年。
正因如此,包括中国在内的世界主要国家和地区均通过对药品进行专利期限补偿,弥补新药上市审评占用的专利保护期,以便专利权人在药品上市后仍能拥有足够的时间来回收研发成本。失去该制度的保护,药品的研发回报率和市场竞争力都将大大削弱。
然而,即便存在PTE政策差异,近年来在我国获批的原研药品中,“全球新”的药品有所增长,但“中国新”仍对“全球新”形成了数量碾压之势。数据显示,2018年至2024年(截至8月底),跨国药企在中国共获批432个“中国新”药品,而“全球新”药品仅获批76个。
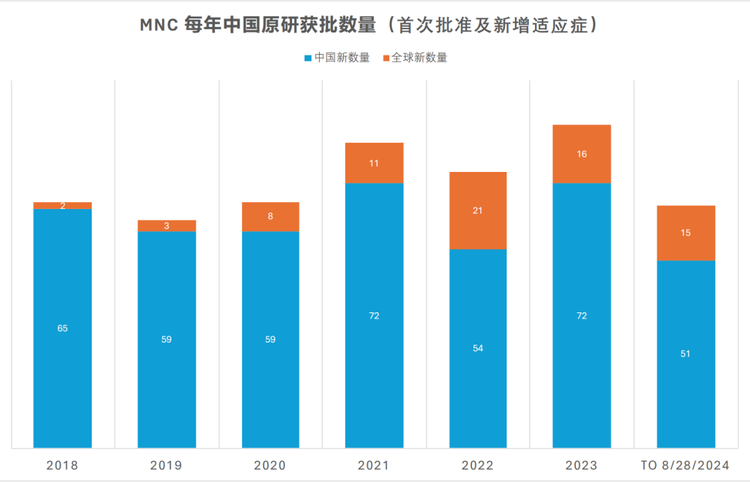
“全球新”路径为何无法成为广大药企的主流选择?追根溯源,“全球新”的实现需要全球研发节奏、监管政策、临床资源等多重因素的精准协同。然而,现实场景中诸多客观条件的共同作用,却很大程度上限制了“全球新”药品的开花结果。
首先是临床试验阶段的时间差与资源错配。实现药品“全球新”的一大核心前提是进行全球多中心临床试验(MRCT),但我国由于审批政策原因,MRCT的启动往往较为滞后。过去,中国的临床试验申请(IND)采用明示审批制且缺乏明确审限,使得相当一部分MRCT在境外放行的同时,在国内却因等待审批而搁置,进而影响后续的新药上市审批同步申报。即使在2018年我国IND审批政策优化改革,采用60日到期默示许可制以后,中国患者入组效率的落后、优质临床PI(主要研究者)资源的分配不足、人群药物的代谢差异、各国监管要求的不同等外部因素,也制约着新药在中国与全球其他国家和地区的同步申报。
其次是上市审批阶段的监管体系地域差异与衔接成本。尽管我国已于2017年加入国际人用药品注册技术协调会(ICH),并在近年来与世界其他国家和地区就新药研发、注册技术标准的制定和协调事宜取得了一定进展,但监管标准的本土化特性仍难以完全消除。举例而言,在包含中国的MRCT顺利结束后,相关药物在欧、美、日等市场上往往可直接基于现有试验数据及标准化药学资料提交上市申报,而在我国却可能还需满足药学技术资料、检验标准等方面的额外的材料要求。
这是因为我国对于新药上市审批的递交材料的要求,与欧、美、日等国家或地区存在重要差异。比如,在药学技术资料方面,我国对药品生产工艺的细节披露、杂质控制策略、稳定性研究数据的维度要求有时更为具体,部分已在境外通过审批的工艺参数在国内仍需补充验证数据。完成这些额外的材料准备工作,通常就需要耗费较长时间,拖延了在中国的申报时间;与此同时,部分创新药又通过境外国家或地区普遍设置的快速审批通道,缩短了产品获批上市的周期,从而导致本应同步实现的“全球新”药品沦为“中国新”。
最后是药企自身的研发管理与资源约束。中小企业由于研发资源有限,往往采用“阶梯式上市”策略,即先在欧美国家完成关键临床试验,推动新药上市、回收成本,而后再逐步向中国等新兴市场拓展。即使是研发资源相对充足的跨国药企,也可能出于平衡药品研发的商业回报与风险控制的考量,选择在欧美成熟市场优先进行新药布局。
中国本土药企引进海外药物时,也可能因来不及完成桥接试验、补充中国人群数据,或因境外研发进度超出预期,导致无法实现药品在我国境内与境外的同步上市。此外,部分药物还可能因不同国家和地区的疾病流行病学、医疗实践等差异,不适合开展MRCT。以上种种因素,都将导致药品丧失“全球新”资格的结果。
高投入、长周期,被忽略的“中国新”药品高额研发成本
如前文所述,基于我国药品临床试验、上市审批制度的现状以及广大药企自身的局限因素,理论上更优的“全球新”路径在现实中只能成为新药上市的小众赛道,“中国新”路径往往才是对药企而言更具实操性的选择。但是,这并不意味着“中国新”药品的医疗价值和创新性逊于“全球新”药品,亦不能推导出“中国新”药品的研发投入和风险必然低于“全球新”药品的结论。事实上,已有实证研究显示,“中国新”药品在华上市前需完成的一系列本土化研发工作,其资金投入、时间成本与风险承担并不低于“全球新”药品,部分复杂品种的投入甚至更高。
当前,针对“中国新”药品,我国已建立了分类注册与灵活审批体系,允许通过普通临床试验、桥接试验、免临床(直接采用境外数据)三种路径申报,同时衔接优先审评、突破性治疗等加速政策。即便如此,2024年在中国获批的境外新药,相对其全球首次上市时间仍平均滞后3.83年[2]。临床试验要求是影响此类“中国新”药品上市进度的关键因素。
采用普通临床试验路径,需在中国开展完整的III期临床试验或含充分中国亚组的全球多中心试验,能够最大程度降低监管部门对境外数据与中国人群相关性的疑虑,但相应的试验成本也最为高昂。以“中国新”药品中的两大注册类别——化学药品5.1类(境外上市的原研药品/具有明显临床优势的改良型药品)和治疗用生物制品3.1类(境外生产的境外已上市、境内未上市的生物制品)为例。
据统计,2016-2024年,在我国获批的化学药品5.1类和治疗用生物制品3.1类中,通过普通临床试验路径支持NDA申报的占比分别为53.37%和50.51%[3]。上述比重近年来已有所下降,但仍超过了50%。可以预见的是,在未来一段时期内,普通临床试验路径仍将是药企推动“中国新”药品上市的最主流路径,因此带来的成本压力也将继续沉重地压在药企肩头。
那么,采用桥接试验或免临床路径,能否有助于减轻“中国新”药品的研发成本?答案仍是不确定的。对于通过桥接试验路径获批上市的“中国新”药品,监管机构通常在批准时会附加上市后研究要求。据统计,2023-2024年,通过桥接试验路径获批的化学药品5.1类和治疗用生物制品3.1类药品中,需要开展某种形式的上市后研究的比例均达到75%[4]。
而对于通过免临床(直接采用境外数据)路径获批上市的“中国新”药品来说,即使在获批时免除了大型临床试验要求,监管部门仍会在批准条件中要求申请人在药品上市后收集一定的本地人群数据或真实世界证据,以持续评估药品疗效和安全性。根据公开可查询数据,在2023年以来的19件通过免临床路径获批上市的化学药品5.1类和治疗用生物制品3.1类药品中,需要开展上市后研究的药品有12个,占比达63.2%[5]。
总体来看,相比于“全球新”药品,“中国新”药品的研发不仅需要承担同等甚至更高的研发投入,其时间成本同样也是只高不低。举例来说,2016-2024年,在我国获批的341个化学药品5.1类,从关键临床开始到在国内申请上市的平均用时是861天,而同期获批的115个“全球新”化学药品1类的平均用时仅为679天,二者相差近半年之久;在我国获批的99个治疗用生物制品3.1类,从关键临床开始到在国内申请上市的平均用时是618天,同期获批的52个“全球新”治疗用生物制品1类的平均用时为617天,二者基本相当[6]。
更长的研发周期,往往也意味着更高的机会成本。“中国新”药物在华上市时,核心专利往往仅剩余较短期限。以2024年获批的化学药品5.1类和治疗用生物制品3.1类为例,两者的平均专利剩余期限仅为5.64年和5.75年[7],且无法获得“全球新”药品所拥有的最长5年的专利期限补偿。这种时间差导致“中国新”药物的市场独占期显著缩短,企业需在更短时间内回收研发投入,使得投资风险进一步提高。
平权赋能多方共赢,专利期限补偿普惠助推良性创新循环
对于全球各地的监管部门而言,药品审批审评政策的核心目标都应是平衡创新激励与公众用药可及性。“全球新”药品固然是医药自主创新的重要标志,但不应成为衡量药品价值与政策待遇的唯一标准。医药研发的多重现实约束,决定了“中国新”药物仍将长期存在,相关药企的在华研发投入与药物自身的创新价值,也理应获得同等的尊重与保护。
首先,从权利与义务对等、成本与回报相称的角度来看,“中国新”药物无论就研发成本还是时间周期而言,在相当程度上均持平甚至超过了“全球新”药物,其沉没成本同样需要得到公平补偿。PTE制度对两类药品的差别待遇,将造成“中国新”药品面临“高投入低保护”的普遍困境,削弱跨国药企在中国引入以及本国药企许可引进(license-in)海外优质药品的积极性。
其次,从域外实践来看,美国、欧盟、日本等主要经济体的药品专利期限补偿制度均未将“境外已上市”作为排除条件,仅关注药品在境内的临床试验与审批耗时。相比之下,我国PTE制度对“中国新”药品的区别待遇,将导致同一药物在华的专利保护期显著短于国际市场,致使部分药企选择优先布局海外市场而延迟在中国的上市时间。在我国药品审评审批制度进一步与国际通行规则接轨的过程中,这显然是一个亟待优先调适的问题。
最后,从用药可及性和产业前瞻性角度来看,消除对“中国新”药物的PTE政策歧视,不仅将有利于增加中国患者的用药选择,实现“多药可及、优价可及”的长远目标,也将有助于形成更加良性的市场竞争格局,推动中国医药产业通过优质药品的“引进—消化—再创新”实现技术升级,增强中国医药产业的全球竞争力。
总结言之,破除对“中国新”药品的PTE制度歧视,宗旨始终在于让“中国新”药物成为连接全球医药创新与中国患者的重要桥梁,同时以公平规则保障国内市场的良性创新循环,打造企业有回报、患者有福祉、产业有未来的良性生态。相信在医药创新与药品可及性的不断再平衡中,“健康中国2030”目标的实现也将触手可及。
注释:
1.申少铁:创新药加速上市,质量如何保障(民生一线),证券时报网:https://www.stcn.com/article/detail/3526624.html,访问日期:2025年12月10日。
2.葛永彬、楼长刚、董剑平、邵亚光:《境外已上市原研药在中国注册必要临床试验现状分析》,载《中国食品药品监管》,2025年第11期。
3.同注2。
4.同注2
5.同注2
6.同注2
7.同注2
(本文仅代表作者观点,不代表知产财经立场,平台并不承诺对内容负责,如有相关疑问,请联系文章作者。)














 京公网安备 11010502049464号
京公网安备 11010502049464号